Back ميوغلوبين Arabic Mioqlobin Azerbaijani Миоглобин Bulgarian মায়োগ্লোবিন Bengali/Bangla Mioglobina Catalan Myoglobin Czech Myoglobin Danish Myoglobin German Μυοσφαιρίνη Greek Myoglobin English
Mioglobin (grč. μυς - mys = mišić + lat. globus = kugla) je protein sa vezom željezo-kisik, koji se nalazi u mišićnom tkivu kičmenjaka općenito, a osobito sisara. To je citoplazmatski globularni hemoprotein sastavljen od jednog polipeptidnog lanca, koji sadrži 154 aminokiselina. Relativno je mali protein (Mr=17.600) – prisutan najčešće u mišićnim ćelijama srca i oksidativnim vlaknima skeletnih mišića. Karakterizira ga funkcijska sličnost sa hemoglobinom, jer oba dvosmjerno vežu kisik (O2) i tako olakšavaju transport O2 od crvenih krvnih zrnaca do mišićnih mitohondrija tokom pojačane metaboličke aktivnosti ili mogu biti rezervoari O2 za vrijeme hipoksije ili anoksije. Međutim, za razliku od hemoglobina, monomer mioglobina sa jednim O2 vezujućim mjestom, ima hiperboličnu O2-saturacijsku krivu, koja je karakteristična za normalnu Mihaelis-Menten enzimsku kinetiku, pravilniju nego što je sigmoidna kriva koja je svojstvena tetramernom hemoglobinu.[5][6]
Kod ljudi, mioglobin se u krvotoku može naći samo nakon ozljede mišića. To je abnormalan nalaz, a može biti dijagnostički relevantan kada se nađe u krvi.[7]

R grupe podupiru O2-vezujuće mjesto
Mioglobin je primarni biološki pigment prenosnik kisika u mišićnom tkivu. Visoke koncentracije mioglobina u mišićnim ćelijama omogućavuju organizmu da zadrži dah na duži vremenski period. Roneći sisari, kao što su kitovi i delfini, imaju mišiće sa posebno visokim obiljem mioglobina. Mioglobin se u mišićima nalazi kao tip I, tip II A i tipa II B, ali većina izvora smatra da se mioglobina ne može se naći u glatkim mišićima.[8][9]
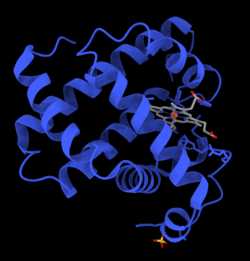
Mioglobin je bio prvi protein kod kojeg je nađena trodimenzijska struktura putem kristalografije X-zracima.[10] Ovo postignuće je objavio John Kendrew sa saradnicima, u 1958. Za ovo otkriće, John Kendrew i Max Perutz su dobili zajedničku Nobelovu nagradu za hemiju, 1962. Uprkos tome što je jedna od najvažnijih studija proteina u biologiji, fiziološka funkcija mioglobina još uvijek nije pouzdano utvrđena: genetički modificirani miševi kojima nedostaje mioglobina su održivi, ali ispoljavaju smanjenje od oko 30% normalnog volumena krvi koji se pumpa iz srca za vrijeme kontrakcije. Oni su prilagođeni na ovaj nedostatak putem prirodne reakcije na nedovoljan dotok kisika (hipoksiju) i širenje krvnih sudova (vazodilataciju). Kod ljudi mioglobin je kodiran genom sa oznakom MB.[11]
- ^ a b c GRCh38: Ensembl release 89: ENSG00000198125 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000018893 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Međedović S., Maslić E., Hadžiselimović R. (2000): Biologija 2. Svjetlost, Sarajevo, ISBN 9958-10-222-6.
- ^ Borovac I., Ur. (2012): Čovjek - velika ilustrirana enciklopedija. Mozaik knjiga, ISBN 978-953-196-999-4.
- ^ Nelson D. L., Cox M. M. (2013): Lehninger principles of biochemistry. W. H. Freeman and Co., ISBN 978-1-4641-0962-1., https://books.google.com/books?id=5Ek9J4p3NfkC&dq=nelson+2000+Lehninger+Principles+of+Biochemistry&q=myoglobin}} (Google books link is the 2008 edition)
- ^ Hadžiselimović R., Pojskić N. (2005): Uvod u humanu imunogenetiku. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-3-4.
- ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Ed. (2005): Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-1-8.
- ^ (U.S.) National Science Foundation: Protein Data Bank.
- ^ Hall J. E., Guyton A. C. (2006): Textbook of medical physiology, 11th edition. Elsevier Saunders, St. Louis, Mo, ISBN 0-7216-0240-1.
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search